Эпоха цифровизации системы здравоохранения РФ и связанная с ней необходимость внедрения в работу медучреждений высококачественных технологий с применением искусственного интеллекта, принуждает правительство разрабатывать и утверждать законодательные акты, регламентирующие данный процесс.
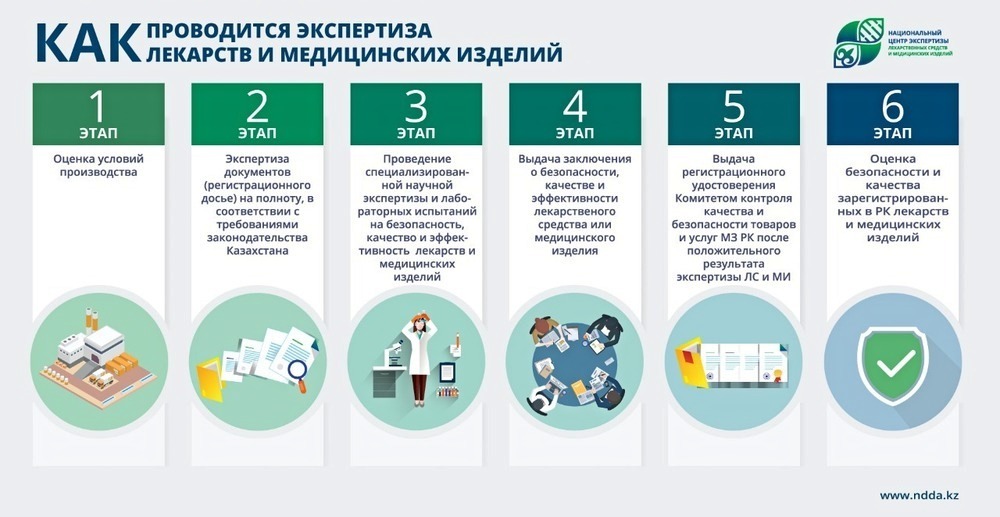
С 1 сентября оценка качества, рентабельности и надежности медицинских изделий будет проходить по-новому. Подробнее о регламенте проведения экспертизы можно узнать из приказа Министерство здравоохранения Российской Федерации от 22.04.2021 № 386н.
Изменения коснуться порядка проведения экспертной оценки качества программного обеспечения, которое является медизделием, в том числе ПО с использованием технологии искусственного интеллекта.
Согласно приказу, медицинское изделие обязано проходить данную экспертизу в случае первичной государственной регистрации, либо в случае необходимости внесения поправок в его регистрационное досье.
Экспертная оценка медизделий, в зависимости от их класса потенциального риска применения, различается и проводится в один или два этапа. Экспертиза программного обеспечения приравнивается к аналогичной процедуре для медицинских изделий низкого класса риска.
Также утвержден перечень оснований для отказа в регистрации медицинских изделий Причиной для этого могут послужить:
• несоответствие сведений, указанных производителем в сопровождающей документации;
• не доказанная безопасность изделия;
• отсутствие данных, подтверждающих его качество;
• высокие риски при его использовании.
Госконтроль проводят подведомственные Федеральной службе по надзору в сфере здравоохранения учреждения.